原子轨道
轨道指的是围绕着原子运动的电子运行的轨道,更准确地说是电子出现在外空间某个地方的概率,有 s、p、d、f、g、h 等。
原子轨道说明
s 有 1 个轨道、p 有 3 个轨道、d 有 5 个轨道、f 有 7 个轨道、g 有 9 个轨道、h 有 11 个轨道等,依此类推。每个轨道上,最多能够容纳 2 个电子。
示例:原子核 ) 1s ) 2s 2p ) 3s 3p 3d ) 4s 4p 4d 4f ) 5s 5p 5d 5f 5g ) 6s 6p 6d 6f 6g 6h )....
- 第 1 层外层只有 1 个 s 轨道,轨道总数量为 1=1²,最大可容纳电子数为 2*1²=2;
- 第 2 层外层有 1 个 s 轨道和 3 个 p 轨道,可容纳的轨道数为 1+3=4=2²,最大可容纳电子数为 2*2²=8;
- 第 3 层外层有 1 个 s 轨道、3 个 p 轨道和 5 个 d 轨道,可容纳的轨道数为 1+3+5=9=3²,最大可容纳电子数为 2*3²=18;
- 可推导第 n 层电子层,可容纳的最多轨道数为 n²,可容纳的最多电子数为 2n²
围绕原子核运动的电子具有的能量是量子化的,也就是说电子的能量只能是几种确切的数值,并不是任意的。电子从外界得到能量时,会从低能级跃迁到高能级(激发态),返回低能级时会以光的形式释放能量。
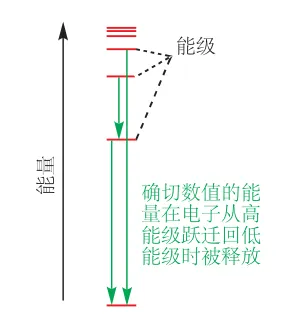
电子围绕原子核在三维空间中的运动不能被精确定位,只能确定其在一个位置出现的概率,将不同位置的概率合并在一起,即为电子运动的区域,称为原子轨道。原子轨道描述的是电子能量可能取值的一种,即能级,当电子处于某一能级时,我们称其占据某一轨道。

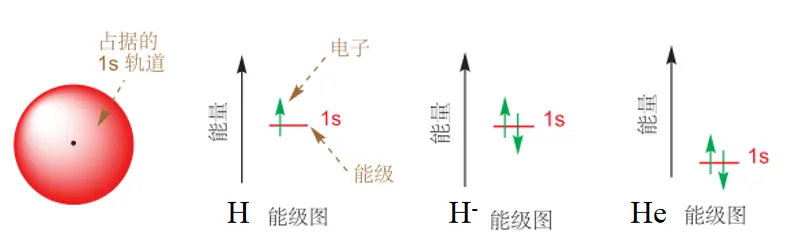
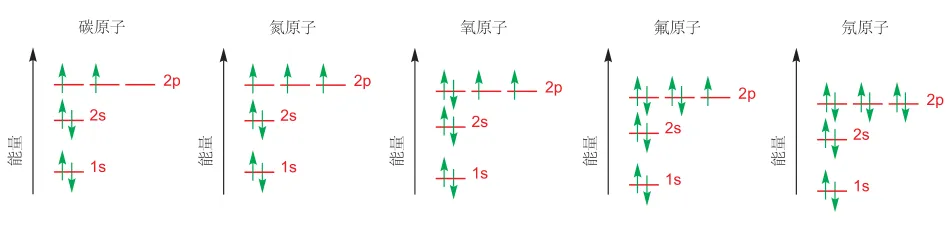
1s 轨道是围绕原子核成球形分布的区域,分布在该轨道的电子,只在这个范围内运动。对于氢原子而言,其核外有一个电子,则其单独占据 1s 轨道。对于氢负离子,核外有两个电子,则两个电子共同占据 1s 轨道,且这两个电子自旋方向相反,我们用两个朝向相反的箭头表示这两个电子。氦原子与氢负离子类似,也是两个电子共同占据 1s 轨道,不同的是由于氦原子核具有两个正电荷,对核外电子吸引更强,因此其轨道能量更低。
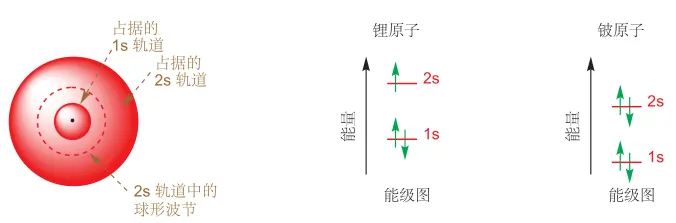
对于 Li 和 Be,其核外分别有 3 个、4 个电子,而一个原子轨道最多只能容纳两个电子,即泡利不相容原理,第 3、4 个电子必须去占据 1s 轨道之外更高能量的轨道,我们称为 2s 轨道。2s 轨道也是球形的,与 1s 不同的是,2s 轨道有一个波节,在该节面电子不会出现。
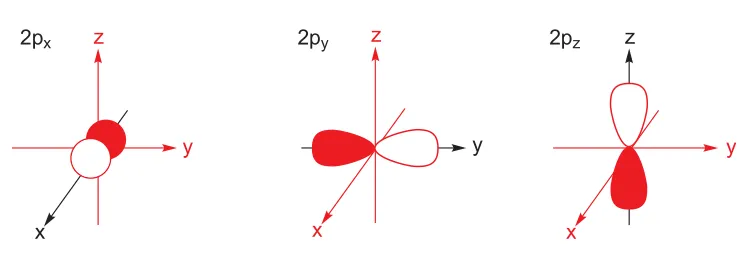
B 原子核外有 5 个电子,除去 1s、2s 轨道各占据的两个电子,还有另外一个电子,只能去占据能量更高的轨道,称为 p 轨道。p 轨道外形类似螺旋桨,桨中心仍然有一个波节。其共有三个能量一致的轨道,称为简并轨道,区别在于这三个轨道的朝向不同,分别沿着三个坐标轴分布,分为
B 原子的第五个电子当然填充在 2p 的一个轨道中,而对于 C 原子,p 轨道分布两个电子,这时由于电子间存在排斥力,2p 轨道有三个空的简并轨道,它的两个电子则单独各占据一个轨道,即洪特规则。直到 2p 轨道中分布超过 3 个电子时,例如 O 原子在 2p 轨道有 4 个电子,则第四个电子会选择其中一个电子配对,一个轨道最多容纳 2 个电子,因此 2p 轨道最多可容纳 6 个电子。
对于 2p 轨道,中间的节面将其分为两个部分,阴影部分和空白部分,它们的区别在于相位不同,所谓的相位就是代表波函数的正负,p 轨道的相位可以规定任意一侧为正,而相位的正负并不代表轨道电荷的正负,因为充满电子的轨道都是带负电的。
随着原子序数的增加,例如 Na 原子,2p 轨道也会被充满,继而转向 3s、3p、4s、3d、4p 轨道,但无论如何,这些原子轨道的理论都是类似的。